El síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2), que causa la enfermedad por coronavirus 2019 (COVID-19), es un virus del ácido ribonucleico (ARN) susceptible a la mutación genética. Las mutaciones que se acumulan en el virus a lo largo del tiempo pueden dar lugar a múltiples variantes cuyas características pueden diferir en comparación con la cepa original. Las mutaciones adaptativas resultantes de un solo cambio de aminoácido pueden provocar cambios drásticos en la patogenicidad del virus.
Además, la aparición de variantes del SARS-CoV-2 crea una necesidad constante de mejorar las terapias de vacunas actuales. La variante B.1.351 de SARS-CoV-2, también conocida como variante Beta, causó la segunda ola de casos de COVID-19 en Sudáfrica en octubre de 2020.
Stady: Potente anticuerpo anti-SARS-CoV-2 con eficacia protectora contra variantes mutacionales emergentes. Crédito de la imagen: Design_Cells / Shutterstock.com
Se ha informado que la variante beta del SARS-CoV-2 da como resultado un aumento de la transmisibilidad, así como una disminución de la neutralización por los anticuerpos monoclonales actualmente disponibles, suero de individuos purificados y sueros post-vacunación. en los últimos días Comunicaciones de la naturaleza Los investigadores identificaron y caracterizaron anticuerpos monoclonales (mAb) contra el dominio de unión al receptor (RBD) del SARS-CoV-2 que son activos contra la cepa salvaje del SARS-CoV-2 y su variante B.1.351.
Actividad neutralizante de mAbs 58G6, 510A5 y 13G9
Los científicos en este estudio identificaron 20 anticuerpos neutralizantes que exhiben una alta afinidad por el dominio de unión al receptor (RBD) del SARS-CoV-2 mediante el cribado de muestras de sangre de individuos con COVID-19 recuperados utilizando el sistema de detección de neutralización rápida Abs. La eficacia de neutralización de los mAb se determinó usando concentraciones de inhibición media (IC).50) contra la cepa salvaje del SARS-CoV-2.
Además, los científicos seleccionaron diez anticuerpos con mejor rendimiento de entre los veinte que identificaron y evaluaron su eficacia equivalente utilizando la prueba de neutralización por reducción de placa (PRNT) contra la cepa SARS-CoV-2 de tipo salvaje y la variante B.1.351. Los anticuerpos 58G6, 510A5 y 13G9 mostraron una buena eficacia neutralizante contra el SARS-CoV-2 con IC50 Los valores oscilan entre 1,285 y 9,174 ng / ml.
Los anticuerpos 58G6 y 510A5 también mostraron una buena eficacia neutralizante contra B.1.351 sin verse afectados por la mutación de escape RBD. La mayoría de los 10 mAb de mejor rendimiento identificados en este estudio mostraron actividad neutralizante contra la variante B.1.351.
En particular, 58G6 mostró una afinidad de unión similar a la subunidad S1 de las cepas salvajes B.1.351 y SARS-CoV-2. Los anticuerpos 510A5 y 13G9 mostraron una mayor afinidad de unión a la subunidad S1 de la cepa de tipo salvaje de SARS-CoV-2 en comparación con la subunidad B.1.351 S1. La mayoría de los 20 anticuerpos identificados no mostraron reactividad cruzada con las proteínas SARS o MERS-CoV.
El estudio demostró con éxito que tres mAbs 58G6, 510A5 y 13G9 mostraron una alta eficiencia de neutralización de la cepa original de SARS-CoV-2 y la variante B.1.351.
13G9e y 510A5e como anillos para neutralizar eficazmente los mAbs
Se evaluaron los sitios antigénicos en SARS-CoV-2 para comprender el alto potencial neutralizante de mAb específicos. El ensayo inmunoabsorbente ligado a enzima (ELISA) se realizó con un mejor rendimiento de 20 mA y otros 54 mA.
Los mAb se separaron en cinco grupos basándose en los sitios de reconocimiento de RBD. Se encontró que la región del epítopo de la mayoría de los anticuerpos fuertes neutralizantes se solapaba con el epítopo de 13G9 (13G9e).
Curiosamente, un ensayo ELISA competitivo y resonancia de harina de superficie (SPR) que utilizó el mejor rendimiento de 20 mA mostró que interrumpen directamente la interacción entre la región RBD del SARS-CoV-2 y el receptor 2 de la enzima convertidora de angiotensina (ACE2) en el célula huésped.
Se realizó un ELISA competitivo usando mAb tratados con biotina para determinar si los epítopos estaban correlacionados. Los científicos encontraron que 16 de los 20 mA superiores competían con 13G9, lo que indica que los sitios antigénicos se superponen con 13G9e. Sin embargo, los sitios de los antígenos 510A5, 55A8, 57F7 y 07C1 se superponen con 510A5e.
Estos resultados indican dos clases independientes de epítopos en SARS-CoV-2 RBD, de los cuales 13G9e es un epítopo vital para mAbs neutralizantes potentes contra RBD.
Cóctel de anticuerpos neutralizantes como tratamiento eficaz para COVID-19
Los científicos investigaron el efecto sinérgico de mAbs específicos contra el SARS-CoV-2. Combinaron uno de los tres anticuerpos neutralizantes fuertes 58G6, 510A5 o 13G9 con uno de los mAb que tienen un potencial neutralizante muy bajo.
Curiosamente, todas las formulaciones de anticuerpos probadas mostraron un efecto sinérgico contra el SARS-CoV-2 nativo, lo que indica la utilidad de usar cócteles AB neutralizantes como tratamiento contra COVID-19.
El mAb fuerte 58G6 conserva su afinidad por el RBD de la variante B.1.351
Las regiones del RBD en las que interactúan los Abs neutralizantes fuertes se identificaron mediante la realización de ELISA de péptidos con los péptidos sintetizados. Se encontró que uno de los mAb más fuertes, 58G6, reconoció la región lineal que contiene los aminoácidos 450-457 de SARS-CoV-2 S (S).450-457 ) en RBD.
Se identificó un enlace de hidrógeno único entre RBD y 58G6 en esta región que jugó un papel en el reconocimiento selectivo de esta región lineal por 58G6 y no por 13G9. 13G9 y 58G6 conocen el anillo S470-495 que ha sido reportada como una región importante reconocida por ACE2 y por varios potentes anticuerpos anti-SARS-CoV-2.
Se realizó un análisis de microscopía electrónica criogénica (crio-EM), que determinó la interacción del enlace de hidrógeno entre N94 y un grupo carbonilo en la cadena principal SE484 En lugar de su cadena lateral. Mutaciones como S.E484K Existente en esta región en el caso de variantes como B.1.351 o P.1 no interrumpirá la afinidad de 58G6 por RBD.
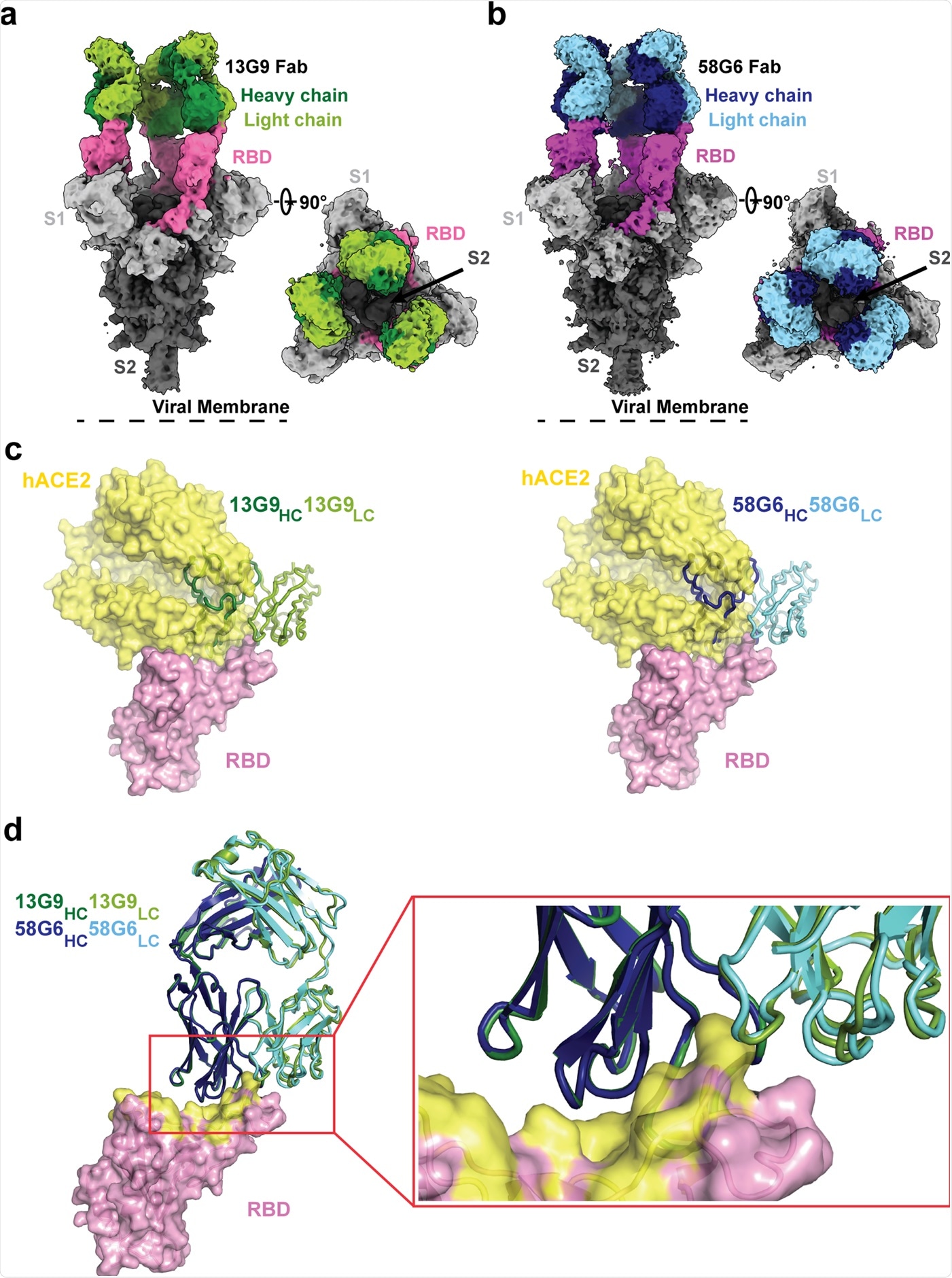
En los ensayos de SPR, se demostró que el mAb 58G6 conservaba la afinidad con la subunidad S1 de la proteína de pico B.1.351. Sin embargo, mAb 13G9 no pudo conservar su proximidad a las variantes de unión a RBD.
El S.E484K La mutación en el RBD de la variante imparte una carga positiva alrededor del R64 ubicado en la región limitante de integración L3 (CDRL3), lo que conduce a la repulsión electrostática y la afinidad de unión reducida de 13G9 al RBD B.1.351. Se observó una ligera disminución en el efecto de neutralización para 13G9 contra la cepa B.1.351.
Sorprendentemente, se observó muy poca similitud de secuencia entre el epítopo reconocido por 13G9 o 58G6 en el SARS-CoV-2 RBD y la región correspondiente en el SARS-CoV. Se observó que la región estaba ausente en MERS-CoV. Esto explica la ausencia de reactividad cruzada de 13G9 o 58G6 hacia SARS-CoV y MERS-CoV.
Además, el estudio también encontró que en el caso de mAb 13G9 o 58G6 fuertes, los RBD estaban en el estado «arriba» durante la interacción con la región de unión parcial al antígeno (Fabs) de los mAb, lo que resultaba en la inaccesibilidad de los RBD. por ACE2. En particular, los mAb 13G9 y 58G6 se aislaron de muestras de sangre de diferentes donantes.
Sin embargo, se observó que ambos mAb se transcribieron a partir de las regiones variables IGHV1-58 e IGKV3-20. Esto indica la importancia del acoplamiento de genes de la línea germinal de IGHV1-58 e IGKV3-20 para neutralizar el SARS-CoV-2 y sus variantes asociadas.
58G6 y 510A5 mostraron resultados positivos en el modelo de ratón transgénico hACE2.
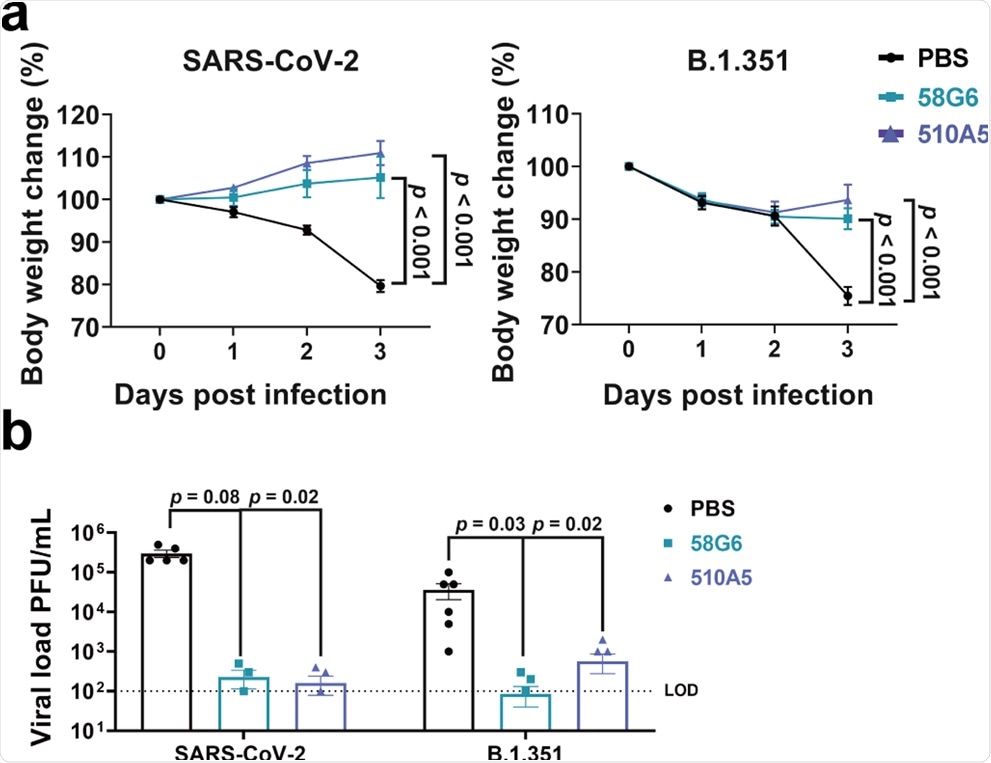
Los mAbs 58G6 y 510A5 mostraron un fuerte potencial neutralizante contra B.1.351. Como resultado, se investigó más a fondo su eficacia en ratones transgénicos hACE2.
En este experimento, a los ratones se les administraron anticuerpos 58G6 y 510A5 o solución salina tamponada con fosfato (PBS) como una inyección intraperitoneal y posteriormente se expusieron por vía intranasal a una cepa de tipo salvaje de SARS-CoV-2 o la variante B.1.351. Se encontró que tanto el grupo 58G6 como el 510A5 de animales tratados expuestos a la cepa de tipo salvaje SARS-CoV-2 pudieron mantener el peso corporal durante tres días después de la infección.
Del mismo modo, en el caso de los animales expuestos a la vitamina B.1.351, tanto 58G6- como 510A5–Los grupos tratados mostraron una pequeña disminución de peso el primer y segundo día después de la infección. Sin embargo, al tercer día, los mAb redujeron con éxito la pérdida de peso. Además, se observó una carga viral reducida de SARS-CoV-2 y B.1.351 después de una dosis única de 58G6 o 510A5.
Estos resultados indican que los mAb 58G6 y 510A5 fueron efectivos contra la infección por SARS-CoV-2 y B.1.351 de tipo salvaje en ratones transgénicos hACE2, lo que indica su potencial como agente protector para COVID-19.
conclusión
El estudio actual identificó dos mAb que son potentes contra SARS-CoV-2 RBD, lo que demuestra una eficacia significativa contra la variante B.1.351. En particular, la mayoría de las ecuaciones Abs reportadas son menos efectivas contra esta variante.
Los dos anticuerpos específicos también mostraron una buena eficacia protectora en ratones transgénicos hACE2. Los resultados de este estudio indican que dos mAbs de amplio espectro contra SARS-CoV-2 RBD tienen el potencial de desarrollarse como un tratamiento profiláctico eficaz contra las variantes del SARS-CoV-2.
Referencia de la revista:
- Lee, T, Han, X, Go, C, et al. (2021). Potente anticuerpo anti-SARS-CoV-2 con eficacia protectora contra variantes mutacionales emergentes. Comunicaciones de la naturaleza. doi: 10.1038 / s41467-021-26539-7.