Detector COVID-19: un ‘clip de aire fresco’ portátil puede detectar virus
El nuevo dispositivo portátil puede alertarlo si ha estado expuesto al COVID-19. Investigadores de la Escuela de Salud Pública de Yale han desarrollado un dispositivo fácil de instalar que puede ayudar a detectar niveles bajos de SARS-CoV-2 y, posteriormente, si una persona ha estado expuesta.
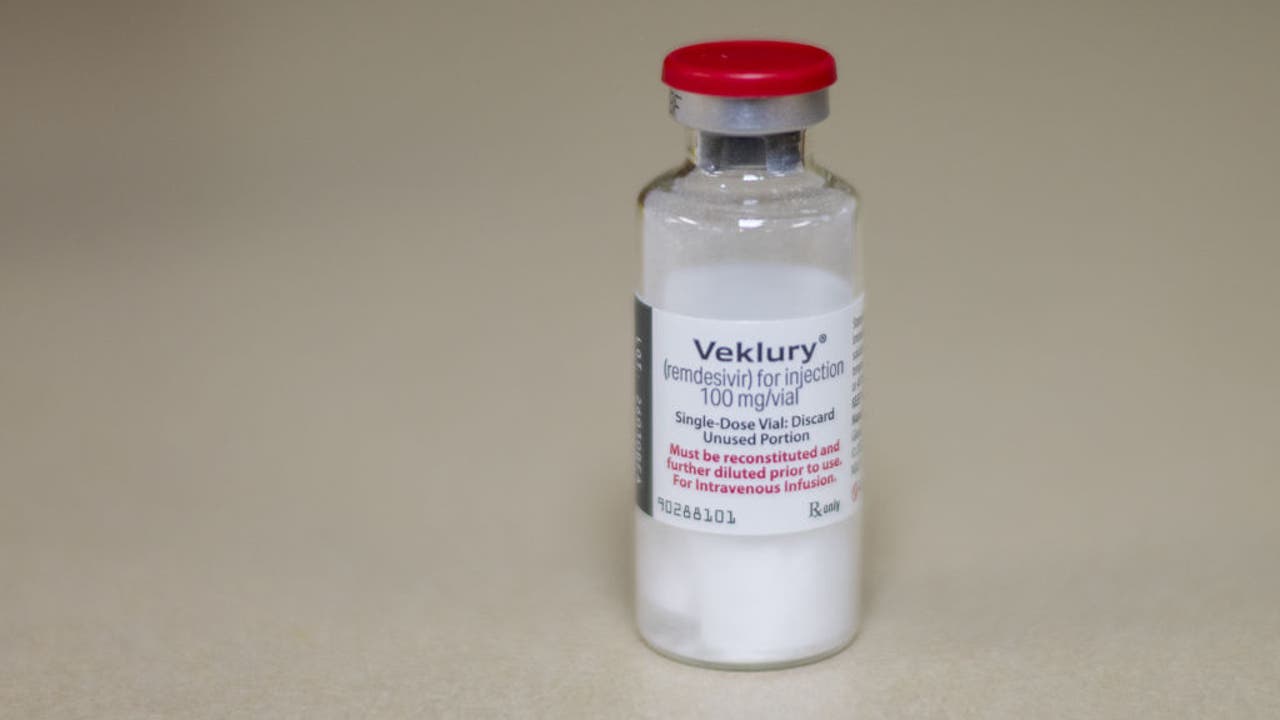
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) tomó medidas el viernes para expandir el uso del medicamento antiviral Remdesivir, Veklury. Para algunos pacientes adultos y pediátricos no hospitalizados Para el tratamiento de la enfermedad COVID-19 de leve a moderada.
Anteriormente, el uso del fármaco Gilead Sciences Inc. Restringido a aquellos que requieren hospitalización.
Patricia Cavazoni, directora del Centro de Evaluación e Investigación de Medicamentos, dijo: Dijo en un comunicado de prensa.
“Los procedimientos de hoy brindan a adultos y niños con COVID-19 de leve a moderado que tienen un alto riesgo de COVID-19 grave, una opción de tratamiento que pueden recibir fuera de un entorno hospitalario tradicional para pacientes hospitalizados, incluidos centros de enfermería especializada, entornos de atención médica domiciliaria e instalaciones clínicas externas como centros intravenosos”.
La agencia amplió la indicación aprobada de Veklury para incluir el uso en adultos y niños de 12 años de edad y mayores, que pesan al menos 88 libras, con resultados positivos de la prueba viral directa para SARS-CoV-2 que no han sido hospitalizados y tienen síntomas leves. síntomas – para moderar COVID-19 y tienen un alto riesgo de desarrollar una enfermedad grave.
Relacionado: Gilead dice que espera que remsphere siga siendo eficaz contra la variante omicron
La FDA también revisó la Autorización de uso de emergencia (EUA) de Veklury para permitir que el medicamento también trate a pacientes pediátricos menores de 12 años, que pesan al menos 3,5 kg a menos de 88 libras, con las mismas condiciones.
Los pacientes de alto riesgo que no están hospitalizados pueden recibir Veklury por infusión intravenosa durante tres días.
La FDA dijo que la aprobación de Veklury para su uso en estos pacientes fue respaldada por un placebo aleatorizado. Ensayo clínico.
El ensayo incluyó a 562 participantes hospitalizados con COVID-19 de leve a moderado que tenían un alto riesgo de progresar a COVID-19 grave.
«El principal resultado medido en el ensayo fue si el paciente fue hospitalizado por algún motivo relacionado con COVID-19 o murió por cualquier causa dentro de los 28 días posteriores al tratamiento. En general, dos de los 279 pacientes que recibieron tratamiento con Veklury preguntaron (0,7 %) hospitalización en comparación con 15 de 283 pacientes que recibieron placebo (5,3%). No hubo muertes en ninguno de los grupos», dijo la FDA.
También señaló que los pacientes pediátricos que estén autorizados a tomar el medicamento recibirán dosis proporcionales a su peso corporal «para lograr exposiciones similares a las de adultos y niños que reciben la dosis aprobada».
Además, la FDA dijo que la autorización se basa en la extrapolación de la eficacia de estudios adecuados y bien controlados en adultos.
«Remdesivir ahora ha ayudado a tratar a más de 10 millones de personas en todo el mundo con COVID-19 y continúa desempeñando un papel clave para ayudar a reducir la carga de la pandemia. Según los datos más recientes, ahora entendemos que remdesivir también es un importante contribuyente a remdesivir «, dijo Daniel O’Day, director ejecutivo de Gilead. Sciences, dijo en una declaración separada: «Eficaz en las primeras etapas de la infección por COVID-19, además de ayudar a los pacientes hospitalizados con la enfermedad». más pacientes en múltiples entornos, también estamos desarrollando nuestros compuestos orales de investigación. Estos compuestos se basan en el mismo mecanismo de acción antiviral que remdesivir y ahora se está realizando un ensayo de fase 1 del antiviral oral COVID-19, GS-5245”.
Los posibles síntomas de Veklury incluyen niveles elevados de enzimas hepáticas, reacciones alérgicas, niveles bajos de oxígeno en la sangre, fiebre, dificultad para respirar, sibilancias, hinchazón, sarpullido, náuseas y sudoración o escalofríos.
Veklury no es un sustituto de la vacunación contra la COVID-19 en personas a las que se recomienda la vacunación y refuerzos.
El 22 de octubre de 2020, la Administración de Drogas y Alimentos de los Estados Unidos aprobó Veklury es para uso en adultos y niños mayores de 12 años que pesan al menos 88 libras.
En particular, en diciembre, Gilead Sciences anunció que retiraría voluntariamente dos piezas de Veklury a nivel de usuario después de quejarse de la presencia de partículas de vidrio.
En un anuncio de la Administración de Drogas y Alimentos, la compañía dijo que no había recibido ningún informe de eventos adversos relacionados con el retiro.
Estudios previos sobre remdesivir han mostrado resultados contradictorios. En noviembre de 2020, la Organización Mundial de la Salud (OMS) recomendó no usar remdesivir en pacientes con COVID-19.